08 Sie 2025
Szpiczak plazmocytowy (szpiczak mnogi) – definicja i rodzaje
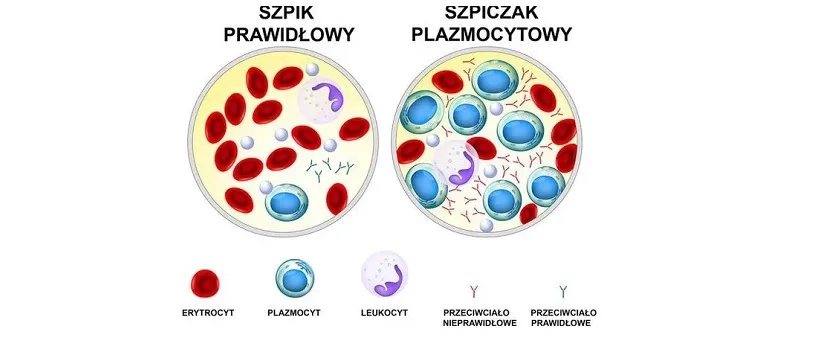
Szpiczak plazmocytowy, inaczej szpiczak mnogi (MM) lub choroba Kahlera, to złośliwy nowotwór układu krwiotwórczego. Polega na niekontrolowanym rozroście klonalnych komórek plazmatycznych w szpiku kostnym, które zazwyczaj wydzielają monoklonalne immunoglobuliny (tzw. białko M). Szpiczak może przybierać różne postaci kliniczne:
Szpiczak mnogi (MM): postać uogólniona, obejmuje cały układ szkieletowy. To najczęstszy typ, w którym komórki plazmatyczne zajmują wiele miejsc kości i wytwarzają nadmierną ilość nieprawidłowego białka.
Plazmocytoma (guz plazmocytowy): pojedyncze skupisko komórek plazmatycznych, zwykle w obrębie kości (najczęściej kręgosłupa) lub rzadziej w tkankach miękkich. Wymaga leczenia miejscowego (chirurgia, radioterapia) i ścisłej obserwacji, ponieważ może przekształcić się w MM.
Szpiczak osoczopochodny (choroba Waldenströma): nietypowa forma związana z nadprodukcją białka IgM. Często zaliczana do chłoniaków limfoplazmocytowych (makroglobulinemii Waldenströma). Objawia się m.in. nadlepkością krwi (ze względu na dużą cząsteczkę IgM) i zaburzeniami neurologicznymi.
Białaczka plazmatyczna: bardzo rzadka, agresywna forma, gdy klonalne plazmocyty występują we krwi obwodowej (>20%).
Inne rzadkie postacie: Zespół POEMS (objawowy zespół polineuropatii, organomegalii, nadmiernych paraprotein); pierwotna amyloidoza AL (odkładanie fragmentów immunoglobulin w narządach); łagodne gammapatie monoklonalne (MGUS, SMM) jako stany poprzedzające MM.
Przyczyny i czynniki ryzyka
Dokładne przyczyny rozwoju szpiczaka nie są znane, ale wyróżnia się kilka czynników zwiększających ryzyko zachorowania. Przede wszystkim chorują osoby starsze (najczęściej po 50–60 r.ż.) oraz mężczyźni. Czynniki ryzyka obejmują m.in.:
Czynniki genetyczne – predyspozycje rodzinne. Ryzyko zachorowania wzrasta u krewnych I stopnia chorych na MM.
Promieniowanie jonizujące – ekspozycja na wysokie dawki promieniowania (np. w wyniku badań radiologicznych) może sprzyjać rozwojowi choroby.
Zatrucia chemiczne – kontakt z chemikaliami, takimi jak benzen, pestycydy, ołów, kadm, azbest czy formaldehyd, jest uznawany za czynnik środowiskowy podnoszący ryzyko MM.
Choroby autoimmunologiczne – przewlekła stymulacja układu odpornościowego w chorobach autoimmunologicznych może zwiększać ryzyko rozrostu klonalnych plazmocytów.
Czynniki immunologiczne – osłabienie odporności (np. przewlekłe infekcje wirusowe czy bakteryjne) może być związane z powstawaniem paraprotein, choć mechanizmy są słabo poznane.
Ogólnie przyjmuje się, że to złożone interakcje predyspozycji genetycznych z czynnikami środowiskowymi i immunologicznymi prowadzą do nieprawidłowego rozrostu plazmocytów. W większości przypadków jednak konkretna przyczyna pozostaje nieokreślona.
Objawy kliniczne szpiczaka
Szpiczak często rozwija się przez długi czas bezobjawowo. Gdy pojawiają się symptomy, są związane głównie z ekspansją komórek nowotworowych w kościach, działaniem monoklonalnych białek i wyniszczającym wpływem na szpik. Do najczęstszych objawów należą:
Bóle kostne – to najczęstszy objaw (występuje u około 70% pacjentów przy rozpoznaniu). Ból zwykle lokalizuje się w kręgosłupie, żeber, miednicy, biodrach, czasem głowie. Bóle nasilają się przy ruchu i mogą się nasilać nocą.
Złamania patologiczne – osłabienie kości przez niszczące procesy osteolityczne prowadzi do złamań przy niewielkim urazie, zwłaszcza kompresyjnych kręgów. Może dojść do obniżenia wzrostu i deformacji kręgosłupa.
Niedokrwistość – ucisk klonalnych plazmocytów na zdrowy szpik powoduje niedostateczną produkcję krwinek czerwonych. Objawia się osłabieniem, bladością skóry, dusznością i szybkim męczeniem. U około 60% pacjentów występuje anemia przy rozpoznaniu.
Nawracające infekcje – nadmiar patologicznych immunoglobulin i zmniejszona ilość prawidłowych przeciwciał upośledza odporność. Chorzy doświadczają częstych zakażeń dróg oddechowych, dróg moczowych, nawet 10 razy częściej niż osoby zdrowe.
Objawy hiperkalcemii – rozpad tkanki kostnej uwalnia wapń do krwi. Nadmiar wapnia może wywoływać nudności, wymioty, zaparcia, bóle głowy, osłabienie mięśni czy skłonność do odwodnienia. U około 10–15% pacjentów hiperkalcemia występuje w momencie rozpoznania.
Niewydolność nerek – część pacjentów (~20–30%) ma w chwili rozpoznania zaburzenia czynności nerek. Wynikają one z odkładania się łańcuchów lekkich immunoglobulin w kłębuszkach nerkowych („nerka szpiczakowa”), odwodnienia, czy powikłań lekowych. Objawia się to obrzękami, podwyższonym poziomem kreatyniny i białkomoczem.
Neuropatia obwodowa i kompresja rdzenia – monoklonalne białka lub ogniska nowotworowe mogą uszkadzać nerwy obwodowe, prowadząc do drętwień, mrowień i zaburzeń czucia. Ponadto złamania kompresyjne kręgosłupa mogą uciskać rdzeń kręgowy, powodując niedowłady, zaburzenia czucia czy nietrzymanie moczu.
Objawy nadlepkości krwi – zwłaszcza w postaci z IgM (Waldenströma) lub przy bardzo wysokim poziomie białka M, mogą wystąpić krwotoki (z nosa, dziąseł), pogorszenie widzenia, zawroty głowy, zaburzenia świadomości.
Ponieważ wymienione objawy są niespecyficzne i mogą towarzyszyć wielu chorobom, rozpoznanie szpiczaka często bywa opóźnione. Należy zgłaszać się na badania, jeśli utrzymują się przewlekle bóle kości, osłabienie, infekcje oraz objawy ze strony nerek czy neurologiczne.
Diagnostyka szpiczaka
Rozpoznanie szpiczaka wymaga wielokierunkowej oceny. Kluczowe badania obejmują:
Badania laboratoryjne krwi i moczu: podstawa to morfologia (w celu wykrycia niedokrwistości), poziom kreatyniny i wapnia we krwi, wskaźniki stanu zapalnego (OB, CRP). Niezbędne jest badanie białek – elektrofereza białek surowicy (SPEP) w kierunku wykrycia tzw. białka M oraz immunofiksacja surowicy i moczu. Dodatkowo oznacza się wolne łańcuchy lekkie kappa i lambda w surowicy, poziom β2-mikroglobuliny (wskaźnik aktywności choroby). Badanie ogólne moczu pozwala wykryć białko Bence’a-Jonesa (łańcuchy lekkie wydalane z moczem). Wykonuje się też poziomy albumin, LDH i inne markery prognostyczne.
Biopsja szpiku kostnego: pobranie próbki szpiku aspiracyjnie (mielogram) i wycinka (trepanobiopsja) w znieczuleniu miejscowym. Ocena histopatologiczna i immunofenotypowa pozwala stwierdzić nadmiar (≥10–60%) klonalnych plazmocytów w szpiku oraz ich cechy molekularne. Badania cytogenetyczne i molekularne na komórkach nowotworowych (np. FISH) identyfikują istotne aberracje chromosomalne (np. del(17p), t(4;14), t(14;16)), ważne dla rokowania.
Obrazowanie medyczne: celem jest ocena zasięgu zmian kostnych. Tradycyjny RTG szkieletu (tzw. kośćca) może wykryć ubytki osteolityczne, ale jest mało czuły. Nowocześniej stosuje się obrazowanie całego ciała – niskodawkową tomografię komputerową (TK) lub rezonans magnetyczny (MRI), które uwidaczniają nawet małe zmiany w kościach i szpiku. Rzadziej wykonywany jest PET-CT (pozytonowa tomografia emisyjna) z znakowaniem glukozą, oceniająca aktywność metaboliczną zmian nowotworowych. W wyjątkowych sytuacjach konieczne jest także wykonanie RTG czaszki.
Badania dodatkowe: w diagnostyce pomocniczo wykonuje się oceny układu krzepnięcia, profil białek (immunoglobuliny IgA, IgG, IgM), a u pacjentów z podejrzeniem powikłań – np. badania neurologiczne czy kardiologiczne (np. echokardiografia przy amyloidozie).
Wszystkie wymienione badania są wykorzystywane w Polsce. Onkolmed Warszawa dysponuje nowoczesnym zapleczem diagnostycznym: hematolodzy Onkolmed oferują pełną diagnostykę hematologiczną – są wykonywane wszystkie podstawowe i specjalistyczne badania krwi i moczu związane z szpiczakiem. Placówka posiada pracownię RTG oraz USG (m.in. badanie płuc i kości), a także kontakt z ośrodkami wykonującymi zaawansowane badania obrazowe (MRI, TK, PET-CT) i genetyczne. W Onkolmed można też wykonać biopsję szpiku. Warto jednak dopytać lekarza prowadzącego, które badania obrazowe wykonuje się bezpośrednio w placówce, a które są realizowane we współpracy z partnerami – nie wszystkie dostępne metody (np. PET-CT) muszą być na miejscu.
Leczenie szpiczaka
Terapia szpiczaka jest wieloetapowa i dostosowana do zaawansowania choroby oraz możliwości pacjenta. Główne metody leczenia to:
Farmakoterapia: podstawą leczenia systemowego są nowoczesne leki celowane. Należą do nich:
Inhibitory proteasomu – np. bortezomib, karfilzomib i iksazomib, które blokują proces rozkładu białek w komórce nowotworowej.
Leki immunomodulujące (tlenione) – talidomid, lenalidomid, pomalidomid, które hamują wzrost komórek szpiczaka i wzmacniają odpowiedź immunologiczną.
Przeciwciała monoklonalne – np. daratumumab, elotuzumab, izatuksyma (izatuksymab) – celują w specyficzne antygeny (CD38, SLAMF7) na powierzchni plazmocytów, niszcząc je. W pierwszej linii u chorych kwalifikujących się do transplantacji standardowo stosuje się skojarzenie czterech leków (schemat Dara-VTD: daratumumab + bortezomib + talidomid + deksametazon).
Chemoterapia klasyczna – rzadziej używana w monoterapii, choć wybrane schematy (melfalan, cyklofosfamid) wchodzą w skład skojarzonych kuracji.
Inne leki celowane – selektywne inhibitory eksportu jądrowego (selinokser) czy inhibitory kinazy BCL2 (wenetoklaks) w specyficznych sytuacjach klinicznych.
Terapia farmakologiczna bywa prowadzona w trybie ciągłym lub w seriach cykli, zależnie od postaci choroby i tolerancji leczenia.
Przeszczepienie komórek macierzystych: u pacjentów młodszych (zwykle <70 r.ż.) i bez poważnych schorzeń współistniejących wykonuje się po indukcji chemioterapią wysokodawkową terapię wysokodawkową z autologiczną transplantacją krwiotwórczych komórek macierzystych (auto-HSCT). Leczenie to znacząco wydłuża remisję. Pacjenci kwalifikowani do auto-HSCT przechodzą najpierw cykle leczenia indukcyjnego (np. Dara-VTD), a następnie autoprzeszczep, po którym włącza się leczenie podtrzymujące (np. lenalidomidem) dla stabilizacji efektu. U starszych lub z obniżoną kondycją stosuje się natomiast chemioterapię bez wprowadzania transplantacji.
Radioterapia i leczenie wspomagające: Radioterapia jest stosowana głównie miejscowo – na ogniska szpiczaka (szczególnie pojedyncze zmiany kostne) albo przy powikłaniach (np. złamaniach kompresyjnych kręgów powodujących ucisk na rdzeń). Pomaga zmniejszyć ból i stabilizować zmiany kostne. Leczenie wspomagające obejmuje m.in. podawanie bisfosfonianów lub denosumabu (leki wzmacniające kości), chemioterapię ukierunkowaną na leczenie niedokrwistości (erytropoetyna) oraz intensywną rehabilitację (zwłaszcza przy uszkodzeniach neurologicznych). Przy ciężkiej hiperkalcemii stosuje się nawodnienie, diuretyki i bisfosfoniany. W razie nadlepkości krwi wykonuje się plazmaferezę.
Innowacyjne terapie: W ostatnich latach pojawiły się w leczeniu szpiczaka przełomowe metody immunoterapii. Najbardziej znana to terapia CAR-T, która polega na genetycznej modyfikacji limfocytów pacjenta do zwalczania komórek szpiczakowych. Pierwsza taka terapia (idekabtagene wicleucel, Abecma) uzyskała w UE w 2022 warunkowe dopuszczenie w wielokrotnie wcześniej leczonym, opornym MM. W badaniach aż ~75% pacjentów odpowiedziało na leczenie (28% uzyskało całkowitą remisję). Kolejną jest cilta-cel (CAR-T przeciw BCMA) – również wykazuje bardzo wysoką skuteczność. Ponadto w badaniach klinicznych testowane są przeciwciała dwuswoiste (ang. bispecific) łączące limfocyty T z plazmocytami, a także kolejne inhibitory nowych celów. Do nowoczesnych leków celowanych należy też przeciwciało koniugowane belantamab mafodotin (Blenrep, anty-BCMA) – dopuszczone w UE dla pacjentów po wielu wcześniejszych terapiach. Szybko rozwijają się nowe terapie celowane i immunologiczne, które w znacznym stopniu wydłużają przeżycie chorych.
Specjaliści leczenia szpiczaka w Onkolmed
W Onkolmed Lecznica Onkologiczna w Warszawie pacjenci ze szpiczakiem mają do dyspozycji multidyscyplinarny zespół specjalistów. Kluczową rolę odgrywają hematolodzy (specjaliści od chorób krwi i szpiku) – na przykład lek. med Anna Ejduk, która prowadzi poradnię hematologiczną Onkolmed. Szpiczaka leczą także onkologowie (onkologia kliniczna) – np. lek. med. Dawid Prószyńskizajmujący się chemioterapią nowotworów. Wspomagają ich radiolodzy diagnostyczni – na przykład lek. med. Andrzej Jezierski, specjalista radiologii i diagnostyki obrazowej, który wykonuje i interpretuje badania obrazowe (USG, RTG, TK, MRI) istotne w diagnostyce. Jeśli wystąpią objawy neurologiczne (np. zaburzenia czucia czy niedowłady spowodowane zajęciem kręgosłupa), pacjent może skorzystać z poradni neurologicznej. W Onkolmed przyjmuje Dr n. med. Tomasz Kmieć – neurolog z wieloletnim doświadczeniem. Ponadto pacjentom konsultacje oferują onkolodzy radioterapeuci (np. Prof. dr ha. n. med. Andrzej Kawecki – radioterapia). Dzięki takiemu zespołowi specjalistów każdy etap leczenia szpiczaka – od diagnozy po terapię – jest skoordynowany.
Zapraszamy do konsultacji w Onkolmed Lecznica Onkologiczna Warszawa
Jeśli Ty lub bliska Ci osoba zaobserwowali powyższe objawy lub masz pytania o diagnostykę i leczenie szpiczaka, zapraszamy do kontaktu z Onkolmed Lecznica Onkologiczna w Warszawie. Dzięki kompleksowej diagnostyce (nowoczesne badania laboratoryjne i obrazowe) oraz opiece zespołu doświadczonych specjalistów (hematologów, onkologów, radiologów) Onkolmed gwarantuje indywidualnie dopasowane leczenie zgodne z aktualnymi standardami. Zachęcamy do umówienia się na konsultację – w Onkolmed na Ursynowie czekają krótkie terminy wizyt. Zadbaj o zdrowie swoje i swoich bliskich – im wcześniej zdiagnozujemy szpiczaka, tym większe szanse na skuteczną terapię.
Źródła: Najnowsze wytyczne Polskiej Grupy Szpiczakowej, rekomendacje i przeglądy medyczne oraz artykuły Onkolmed i DKMS dotyczące szpiczaka.




